OFFERTA SPECIALE
OFFERTA SPECIALE
Tutto il sito - Mese
6,99€ 1 € al mese x 12 mesi
oppure
1€ al mese per 3 mesi
Tutto il sito - Anno
79,99€ 9,99 € per 1 anno
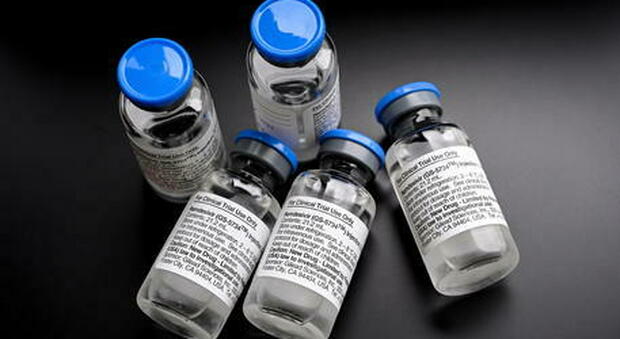
Nonostante la “bocciatura” incassata dallo studio Solidarity dell'Organizzazione mondiale della sanità, la Food and Drug Administration (Fda) degli Stati Uniti ha approvato l'antivirale Veklury (remdesivir) per l'uso in pazienti adulti e pediatrici dai 12 anni in poi per il trattamento di forme di Covid-19 che richiedono il ricovero. Remdesivir «è il primo farmaco per Covid-19 ad essere approvato dalla Fda», fa sapere la stessa agenzia in una nota. Il trattamento «deve essere somministrato solo in un ospedale o in una struttura sanitaria in grado di fornire cure paragonabili a quelle ospedaliere».
In Europa invece «il Remdemsivir ha ricevuto un'autorizzazione condizionata sul mercato europeo.
Leggi l'articolo completo su
Il Mattino